Nguyên tử, một khái niệm tưởng chừng như xa lạ nhưng lại vô cùng gần gũi, là chủ đề trọng tâm trong chương trình Hóa Học Lớp 8 Bài 4. Bài viết này sẽ giúp bạn khám phá thế giới vi mô của vật chất, tìm hiểu về cấu tạo của nguyên tử và vai trò quan trọng của nó trong hóa học cũng như trong đời sống.
Khám phá thế giới nguyên tử: Từ triết học đến khoa học hiện đại
Ngay từ thời Hy Lạp cổ đại, con người đã nhen nhóm ý tưởng về sự tồn tại của những hạt vật chất siêu nhỏ, không thể phân chia được, gọi là nguyên tử. Trải qua hàng thế kỷ, với sự phát triển vượt bậc của khoa học, đặc biệt là sự ra đời của các phương pháp nghiên cứu hiện đại, chúng ta mới có thể khẳng định được sự tồn tại của nguyên tử và từng bước khám phá cấu trúc bên trong của nó.
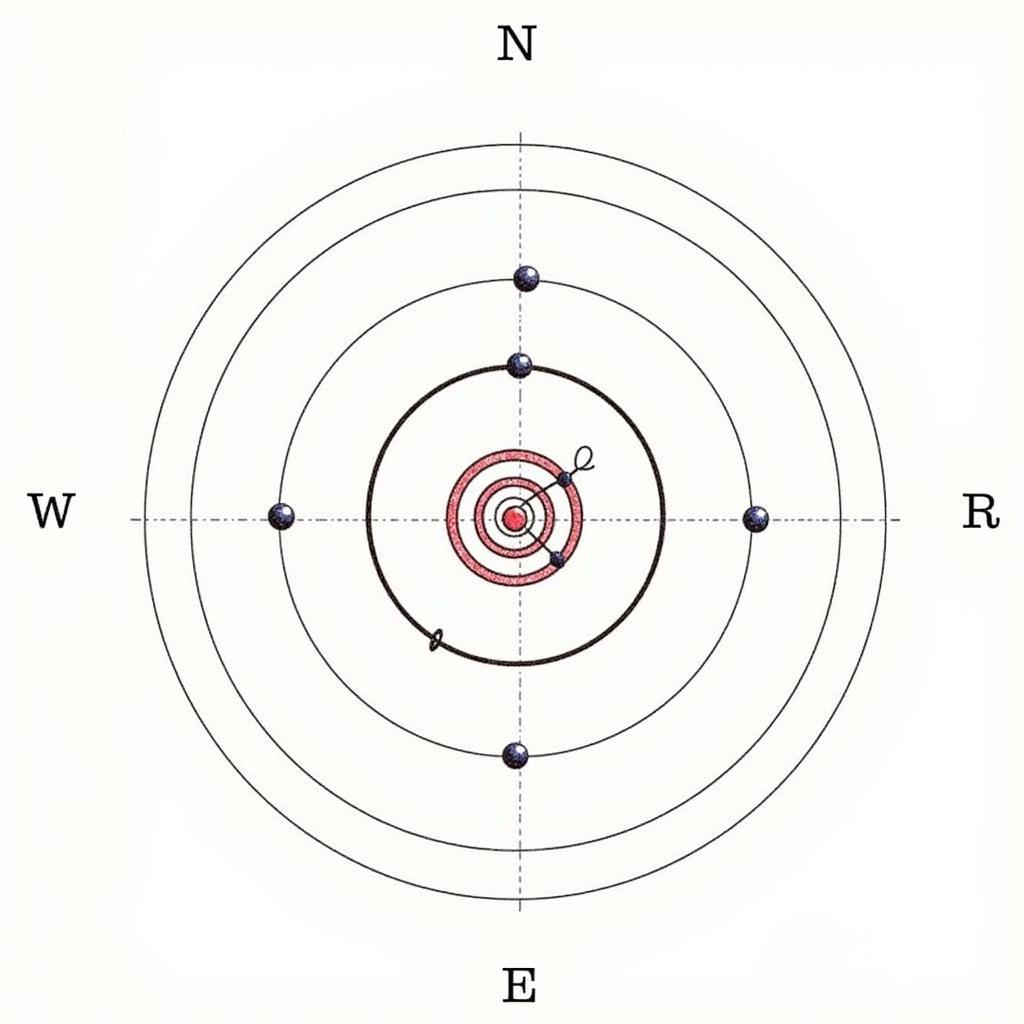 cấu tạo nguyên tử
cấu tạo nguyên tử
Cấu tạo của nguyên tử: “Ngôi nhà” của proton, neutron và electron
Nguyên tử được cấu tạo từ 3 loại hạt cơ bản: proton, neutron và electron. Trong đó:
- Proton (p): Mang điện tích dương (+1), nằm ở hạt nhân nguyên tử.
- Neutron (n): Không mang điện tích, nằm ở hạt nhân nguyên tử cùng với proton.
- Electron (e): Mang điện tích âm (-1), chuyển động rất nhanh xung quanh hạt nhân.
Hạt nhân mang điện tích dương, còn electron mang điện tích âm. Do đó, nguyên tử trung hòa về điện. Khối lượng của nguyên tử tập trung chủ yếu ở hạt nhân, bởi khối lượng của proton và neutron lớn hơn rất nhiều so với electron.
So sánh proton, neutron và electron
| Hạt | Điện tích | Khối lượng (u) | Vị trí |
|---|---|---|---|
| Proton | +1 | ≈ 1 | Hạt nhân |
| Neutron | 0 | ≈ 1 | Hạt nhân |
| Electron | -1 | ≈ 0 | Vỏ nguyên tử |
Nguyên tố hóa học: Sự đa dạng từ những “viên gạch” cơ bản
Mỗi nguyên tố hóa học được xác định bởi số proton trong hạt nhân, được gọi là số hiệu nguyên tử. Ví dụ, nguyên tử hydro có 1 proton, nguyên tử oxy có 8 proton, … Số proton cũng quyết định tính chất hóa học đặc trưng của mỗi nguyên tố.
Lớp electron và sự hình thành liên kết hóa học
Electron trong nguyên tử không chuyển động tự do mà sắp xếp thành từng lớp, gọi là lớp electron. Mỗi lớp electron có mức năng lượng xác định và chứa tối đa một số lượng electron nhất định. Việc các nguyên tử liên kết với nhau để tạo thành phân tử được quyết định bởi số electron lớp ngoài cùng.
Ứng dụng của kiến thức về nguyên tử trong đời sống
Hiểu biết về nguyên tử và các hạt cấu tạo nên nó là nền tảng quan trọng cho sự phát triển của nhiều ngành khoa học và công nghệ hiện đại, như:
- Công nghệ nano: Tạo ra các vật liệu và thiết bị có kích thước siêu nhỏ với những tính năng vượt trội.
- Năng lượng hạt nhân: Ứng dụng năng lượng giải phóng từ các phản ứng hạt nhân để tạo ra điện năng.
- Y học hạt nhân: Sử dụng các đồng vị phóng xạ trong chẩn đoán và điều trị bệnh.
Kết luận
Hóa học lớp 8 bài 4 đã mở ra cánh cửa dẫn dắt chúng ta đến với thế giới vi mô đầy bí ẩn của nguyên tử – “viên gạch” cấu tạo nên vạn vật. Việc tìm hiểu về cấu tạo, tính chất và vai trò của nguyên tử không chỉ giúp bạn học tốt môn Hóa học mà còn khơi dậy niềm đam mê khám phá khoa học và ứng dụng vào cuộc sống.
FAQ
- Nguyên tử có kích thước bao nhiêu?
- Nguyên tử có kích thước vô cùng nhỏ, đường kính khoảng 0,1 nanomet (1 nanomet bằng 1 phần tỷ mét).
- Làm thế nào để biết được số proton, neutron và electron trong một nguyên tử?
- Số proton bằng số hiệu nguyên tử của nguyên tố đó.
- Số neutron bằng hiệu số khối và số hiệu nguyên tử.
- Nguyên tử trung hòa điện nên số electron bằng số proton.
- Tại sao nguyên tử lại quan trọng?
- Nguyên tử là đơn vị cơ bản cấu tạo nên mọi chất.
- Tính chất của nguyên tử quyết định tính chất của chất.
- Hiểu biết về nguyên tử giúp con người tạo ra những vật liệu và công nghệ mới.
Bạn muốn tìm hiểu thêm về Hóa học?
Liên hệ
Mọi thắc mắc hoặc cần hỗ trợ, vui lòng liên hệ:
- Số điện thoại: 0705065516
- Email: thptquangtrung@gmail.com
- Địa chỉ: NB tổ 5/110 KV bình thường b, P, Bình Thủy, Cần Thơ, Việt Nam
Chúng tôi có đội ngũ chăm sóc khách hàng 24/7.

