Nguyên tử, đơn vị cơ bản của vật chất, luôn là một chủ đề hấp dẫn trong hóa học lớp 10. Bài 4, với trọng tâm “Hóa Học Lớp 10 Bài 4”, sẽ giúp chúng ta đi sâu vào tìm hiểu cấu tạo nguyên tử, từ hạt nhân đến lớp vỏ electron. Chúng ta sẽ cùng nhau khám phá những kiến thức nền tảng quan trọng, mở ra cánh cửa để hiểu rõ hơn về thế giới vi mô đầy bí ẩn.
Hạt Nhân Nguyên Tử: Trung Tâm Của Vật Chất
Hạt nhân nguyên tử, nằm ở trung tâm, chứa proton mang điện tích dương và neutron không mang điện. Số proton (ký hiệu là Z) quyết định nguyên tố hóa học, còn tổng số proton và neutron (ký hiệu là A) quyết định khối lượng nguyên tử. Sự kết hợp giữa proton và neutron tạo nên một khối hạt nhân bền vững, giữ vai trò quyết định trong tính chất của nguyên tử.
Ví dụ, nguyên tử carbon có 6 proton (Z=6) và thường có 6 neutron, tạo nên khối lượng nguyên tử là 12 (A=12). Sự khác biệt về số neutron tạo ra các đồng vị của cùng một nguyên tố.
Lớp Vỏ Electron: Vòng Xoay Xung Quanh Hạt Nhân
Lớp vỏ electron, bao quanh hạt nhân, chứa các electron mang điện tích âm. Các electron này chuyển động rất nhanh trong các lớp và phân lớp electron, tạo thành một “đám mây” điện tích âm xung quanh hạt nhân. Số electron trong lớp vỏ bằng số proton trong hạt nhân, đảm bảo nguyên tử trung hòa về điện.
Cấu hình electron, cách sắp xếp electron trong các lớp và phân lớp, quyết định tính chất hóa học của nguyên tố. Việc tìm hiểu cấu hình electron giúp dự đoán khả năng phản ứng và liên kết của nguyên tử.
Mô Hình Nguyên Tử Hiện Đại: Khái Niệm Orbital
Mô hình nguyên tử hiện đại dựa trên khái niệm orbital, vùng không gian xung quanh hạt nhân có xác suất tìm thấy electron cao nhất. Khác với mô hình nguyên tử Bohr, mô hình hiện đại không mô tả electron chuyển động theo quỹ đạo xác định mà là xác suất phân bố electron trong không gian.
Orbital Nguyên Tử và Số Lượng Tử
Mỗi orbital được đặc trưng bởi bộ ba số lượng tử: số lượng tử chính (n), số lượng tử phụ (l), và số lượng tử từ (ml). Các số lượng tử này xác định năng lượng, hình dạng và sự định hướng của orbital trong không gian. Học cách làm bánh da lợn khoai môn sẽ giúp bạn thư giãn sau những giờ học căng thẳng.
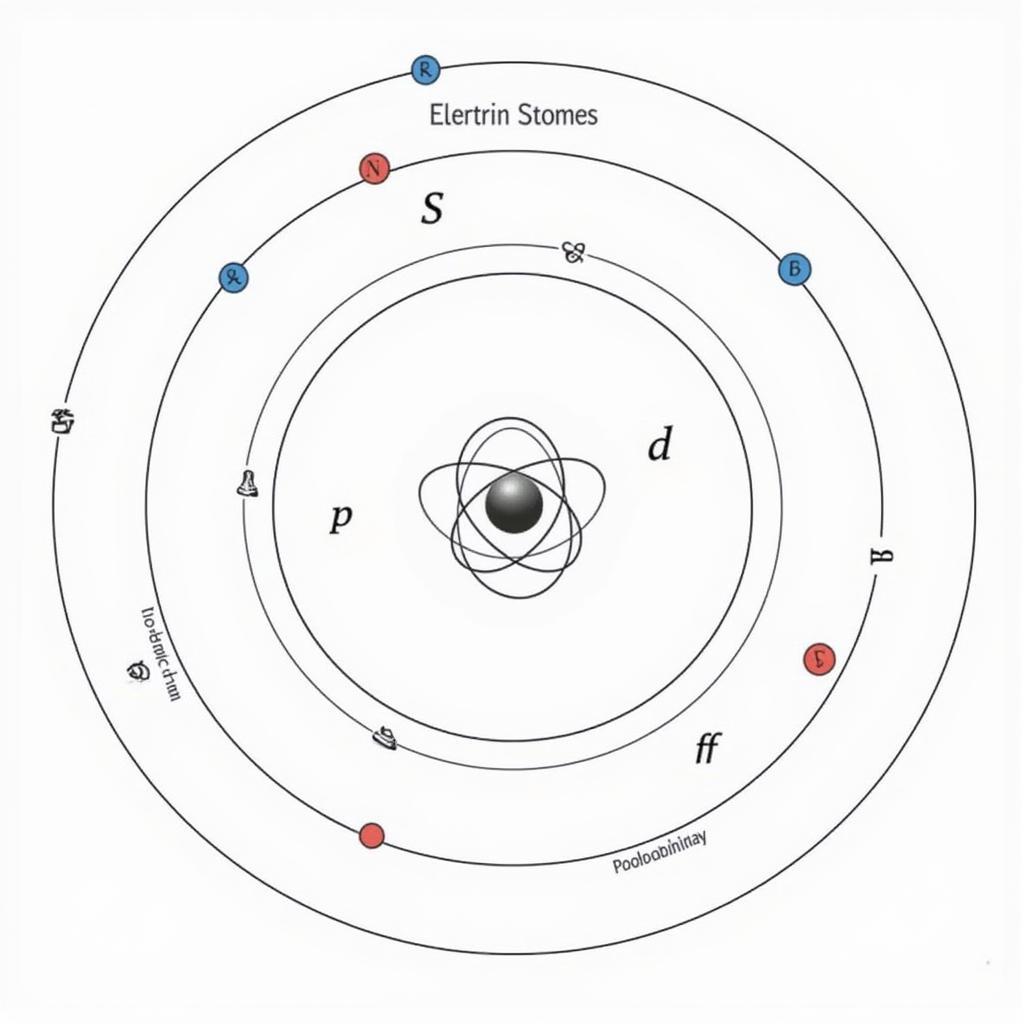 Mô hình nguyên tử hiện đại
Mô hình nguyên tử hiện đại
Tóm Lại Hóa Học Lớp 10 Bài 4
Bài 4 hóa học lớp 10 cung cấp kiến thức cơ bản về cấu tạo nguyên tử, bao gồm hạt nhân và lớp vỏ electron. Hiểu rõ cấu tạo nguyên tử là nền tảng để tiếp tục học tập các bài học tiếp theo trong chương trình hóa học. “Hóa học lớp 10 bài 4” đặt nền móng vững chắc cho việc khám phá thế giới phân tử và phản ứng hóa học.
FAQ về Hóa Học Lớp 10 Bài 4
- Proton và neutron khác nhau như thế nào?
- Số electron trong nguyên tử ảnh hưởng đến tính chất hóa học như thế nào?
- Mô hình nguyên tử hiện đại khác gì so với mô hình nguyên tử Bohr?
- Số lượng tử là gì và ý nghĩa của chúng?
- Làm thế nào để xác định cấu hình electron của một nguyên tố?
- Đồng vị là gì và tại sao chúng quan trọng?
- Cấu hình electron ảnh hưởng đến liên kết hóa học như thế nào?
Các Tình Huống Thường Gặp Câu Hỏi
Học sinh thường gặp khó khăn trong việc hình dung cấu trúc ba chiều của orbital và áp dụng quy tắc Aufbau để viết cấu hình electron. Việc phân biệt giữa các loại liên kết hóa học cũng là một thử thách. Background học online có thể giúp bạn tạo không gian học tập hiệu quả.
Gợi Ý Các Câu Hỏi Và Bài Viết Khác
Bạn có thể tìm hiểu thêm về dấu xấp xỉ trong toán học hoặc cách đăng ký nguyện vọng đại học 2017. Cô giáo cung bọ cạp chửi học sinh là một câu chuyện đáng suy ngẫm về đạo đức nghề nghiệp.
Khi cần hỗ trợ hãy liên hệ Số Điện Thoại: 0705065516, Email: thptquangtrung@gmail.com Hoặc đến địa chỉ: NB tổ 5/110 KV bình thường b, P, Bình Thủy, Cần Thơ, Việt Nam. Chúng tôi có đội ngũ chăm sóc khách hàng 24/7.
