Cấu trúc vỏ nguyên tử là một khái niệm quan trọng trong hóa học lớp 10, giúp chúng ta hiểu rõ hơn về tính chất và cách thức các nguyên tố tương tác với nhau. Trong bài 10 này, chúng ta sẽ cùng nhau khám phá thế giới vi mô của nguyên tử và tìm hiểu về cách các electron sắp xếp trong vỏ nguyên tử.
Mô hình cấu trúc vỏ nguyên tử
Từ những kiến thức cơ bản về nguyên tử đã học, ta biết rằng nguyên tử được cấu tạo từ hạt nhân mang điện tích dương và các electron mang điện tích âm chuyển động xung quanh. Tuy nhiên, chuyển động của các electron này không phải là tự do và hỗn loạn mà tuân theo những quy luật nhất định. Các electron phân bố theo từng lớp, được gọi là lớp electron hay vỏ electron.
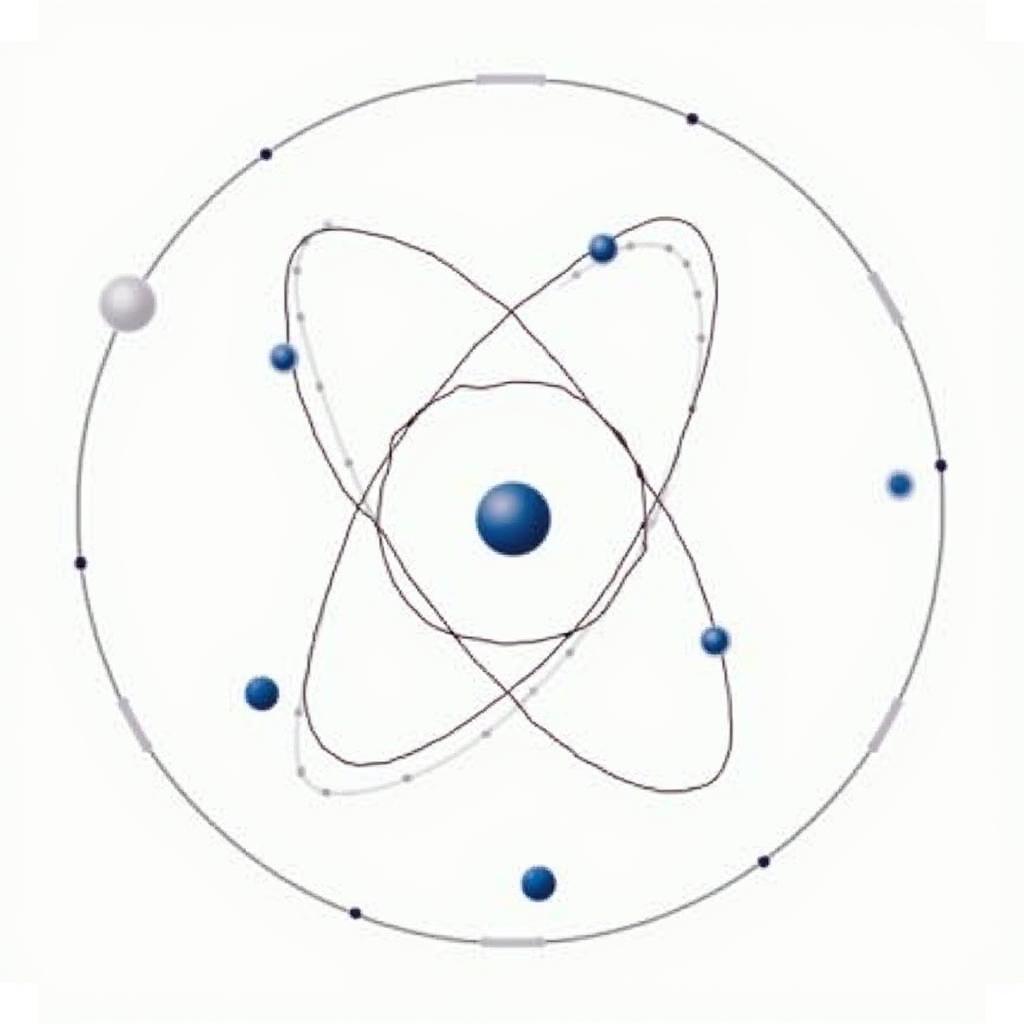 Mô hình cấu trúc vỏ nguyên tử
Mô hình cấu trúc vỏ nguyên tử
Mỗi lớp electron tương ứng với một mức năng lượng xác định. Lớp electron gần hạt nhân nhất có mức năng lượng thấp nhất và mức năng lượng tăng dần khi khoảng cách từ lớp electron đến hạt nhân tăng lên.
Các lớp và phân lớp electron
Theo mô hình nguyên tử hiện đại, các lớp electron được đánh số từ 1 đến 7, hoặc được kí hiệu bằng các chữ cái K, L, M, N, O, P, Q. Mỗi lớp electron lại được chia thành các phân lớp electron, kí hiệu là s, p, d, f. Số phân lớp electron trong mỗi lớp electron bằng số thứ tự của lớp electron đó. Ví dụ:
- Lớp 1 (lớp K) có 1 phân lớp là 1s
- Lớp 2 (lớp L) có 2 phân lớp là 2s và 2p
- Lớp 3 (lớp M) có 3 phân lớp là 3s, 3p và 3d
- …
Mỗi phân lớp electron chứa tối đa một số electron nhất định:
- Phân lớp s chứa tối đa 2 electron
- Phân lớp p chứa tối đa 6 electron
- Phân lớp d chứa tối đa 10 electron
- Phân lớp f chứa tối đa 14 electron
Cấu hình electron nguyên tử
Cấu hình electron nguyên tử cho biết sự phân bố của các electron trong các lớp và phân lớp electron. Để viết cấu hình electron nguyên tử, ta cần tuân theo nguyên lí vững bền và quy tắc Hund:
- Nguyên lí vững bền: Trong nguyên tử, các electron lần lượt chiếm các orbital có mức năng lượng từ thấp đến cao.
- Quy tắc Hund: Trong cùng một phân lớp, các electron điền vào các orbital theo hướng sao cho số electron độc thân là lớn nhất.
Ví dụ: Cấu hình electron của nguyên tử O (Z=8) là 1s2 2s2 2p4.
Ý nghĩa của cấu hình electron
Cấu hình electron nguyên tử cho ta biết nhiều thông tin quan trọng về nguyên tố:
- Vị trí của nguyên tố trong bảng tuần hoàn: Số thứ tự lớp electron ngoài cùng của nguyên tử trung hòa bằng số thứ tự của chu kì; số electron lớp ngoài cùng của nguyên tử trung hòa bằng số thứ tự của nhóm A.
- Tính chất hóa học của nguyên tố: Electron lớp ngoài cùng quyết định tính chất hóa học của nguyên tố. Các nguyên tố có cùng số electron lớp ngoài cùng có tính chất hóa học tương tự nhau.
Kết luận
Hiểu rõ về cấu trúc vỏ nguyên tử là nền tảng quan trọng để học tốt hóa học. Bài 10 đã cung cấp cho các em những kiến thức cơ bản nhất về cấu trúc vỏ nguyên tử. Hãy luyện tập viết cấu hình electron của các nguyên tử khác nhau để nắm vững kiến thức này nhé!
FAQs về cấu trúc vỏ nguyên tử
1. Tại sao các electron không bị hút vào hạt nhân?
Các electron mang điện tích âm và chuyển động liên tục xung quanh hạt nhân mang điện tích dương. Lực hút tĩnh điện giữa hạt nhân và electron đóng vai trò là lực hướng tâm giữ cho electron chuyển động theo quỹ đạo.
2. Làm thế nào để xác định số lớp electron của một nguyên tử?
Số lớp electron của một nguyên tử bằng số thứ tự của chu kì mà nguyên tố đó nằm trong bảng tuần hoàn.
3. Nguyên tắc nào quyết định thứ tự các phân lớp electron được lấp đầy?
Nguyên lí vững bền và quy tắc Hund quyết định thứ tự các phân lớp electron được lấp đầy.
4. Tại sao cấu hình electron lại quan trọng trong hóa học?
Cấu hình electron cho ta biết nhiều thông tin quan trọng về tính chất hóa học của nguyên tố, giúp dự đoán khả năng phản ứng và tạo liên kết hóa học.
5. Làm thế nào để luyện tập viết cấu hình electron hiệu quả?
Hãy luyện tập viết cấu hình electron của các nguyên tử từ đơn giản đến phức tạp, từ số hiệu nguyên tử nhỏ đến lớn.
Bạn cần hỗ trợ?
Nếu bạn cần hỗ trợ về nội dung bài học hoặc có bất kỳ câu hỏi nào, hãy liên hệ với chúng tôi:
- Số Điện Thoại: 0705065516
- Email: thptquangtrung@gmail.com
- Địa chỉ: NB tổ 5/110 KV bình thường b, P, Bình Thủy, Cần Thơ, Việt Nam.
Chúng tôi có đội ngũ chăm sóc khách hàng 24/7 sẵn sàng hỗ trợ bạn.
hóa học lớp 11 bài 10 photpho là bài viết tiếp theo bạn có thể tham khảo sau khi nắm vững kiến thức về cấu trúc vỏ nguyên tử. Bài viết này sẽ giúp bạn tìm hiểu về nguyên tố Photpho và các hợp chất của nó. Hoặc bạn có thể xem hóa học lớp 10 bài 6 để ôn tập lại kiến thức về bảng tuần hoàn các nguyên tố hóa học.

