Liên kết hóa học là lực giữ các nguyên tử lại với nhau để tạo thành phân tử, tinh thể hoặc các loại tập hợp khác. Hiểu rõ về Các Loại Liên Kết Trong Hóa Học là nền tảng quan trọng để nắm bắt được tính chất và phản ứng của các chất. Bài viết này sẽ giúp bạn khám phá chi tiết về các loại liên kết hóa học phổ biến, từ liên kết ion, liên kết cộng hóa trị đến liên kết kim loại và liên kết hydro.
Liên Kết Ion: Sự Cho Nhận Electron
Liên kết ion hình thành do sự cho nhận electron giữa các nguyên tử. Một nguyên tử (thường là kim loại) nhường electron để trở thành ion dương (cation), trong khi nguyên tử khác (thường là phi kim) nhận electron để trở thành ion âm (anion). Lực hút tĩnh điện giữa cation và anion tạo nên liên kết ion. Ví dụ điển hình là NaCl, natri (Na) nhường một electron cho clo (Cl) để tạo thành Na+ và Cl-.
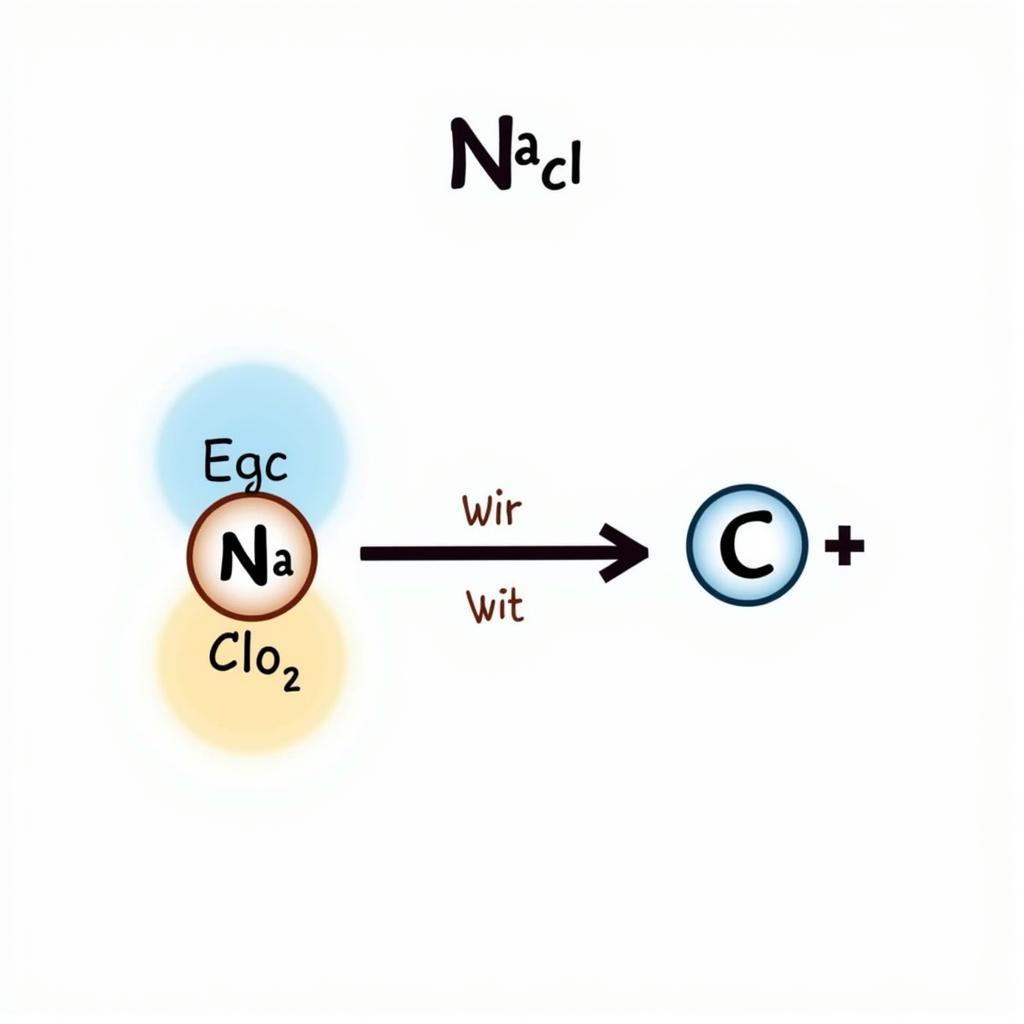 Hình ảnh minh họa liên kết ion trong NaCl
Hình ảnh minh họa liên kết ion trong NaCl
Liên Kết Cộng Hóa Trị: Sự Chia Sẻ Electron
Khác với liên kết ion, liên kết cộng hóa trị được hình thành khi các nguyên tử chia sẻ một hoặc nhiều cặp electron. Kiểu liên kết này thường xảy ra giữa các nguyên tử phi kim. Ví dụ, trong phân tử H2, hai nguyên tử hydro chia sẻ một cặp electron để đạt cấu hình electron bền vững. Liên kết cộng hóa trị có thể là liên kết đơn, đôi hoặc ba tùy thuộc vào số cặp electron được chia sẻ.
 Hình ảnh minh họa liên kết cộng hóa trị trong H2
Hình ảnh minh họa liên kết cộng hóa trị trong H2
Các Loại Liên Kết Cộng Hóa Trị
Liên kết cộng hóa trị được chia thành liên kết cộng hóa trị không phân cực và liên kết cộng hóa trị phân cực. Trong liên kết cộng hóa trị không phân cực, các electron được chia sẻ đều giữa các nguyên tử. Ngược lại, trong liên kết cộng hóa trị phân cực, cặp electron bị lệch về phía nguyên tử có độ âm điện lớn hơn.
Liên Kết Kim Loại: Biển Electron
Liên kết kim loại là liên kết giữa các nguyên tử kim loại. Trong kim loại, các electron hóa trị không thuộc về một nguyên tử cụ thể mà di chuyển tự do trong mạng lưới tinh thể kim loại, tạo thành “biển electron”. Biển electron này liên kết các ion kim loại dương lại với nhau. Tính chất đặc trưng của kim loại như tính dẫn điện, dẫn nhiệt tốt là do sự di chuyển tự do của các electron này.
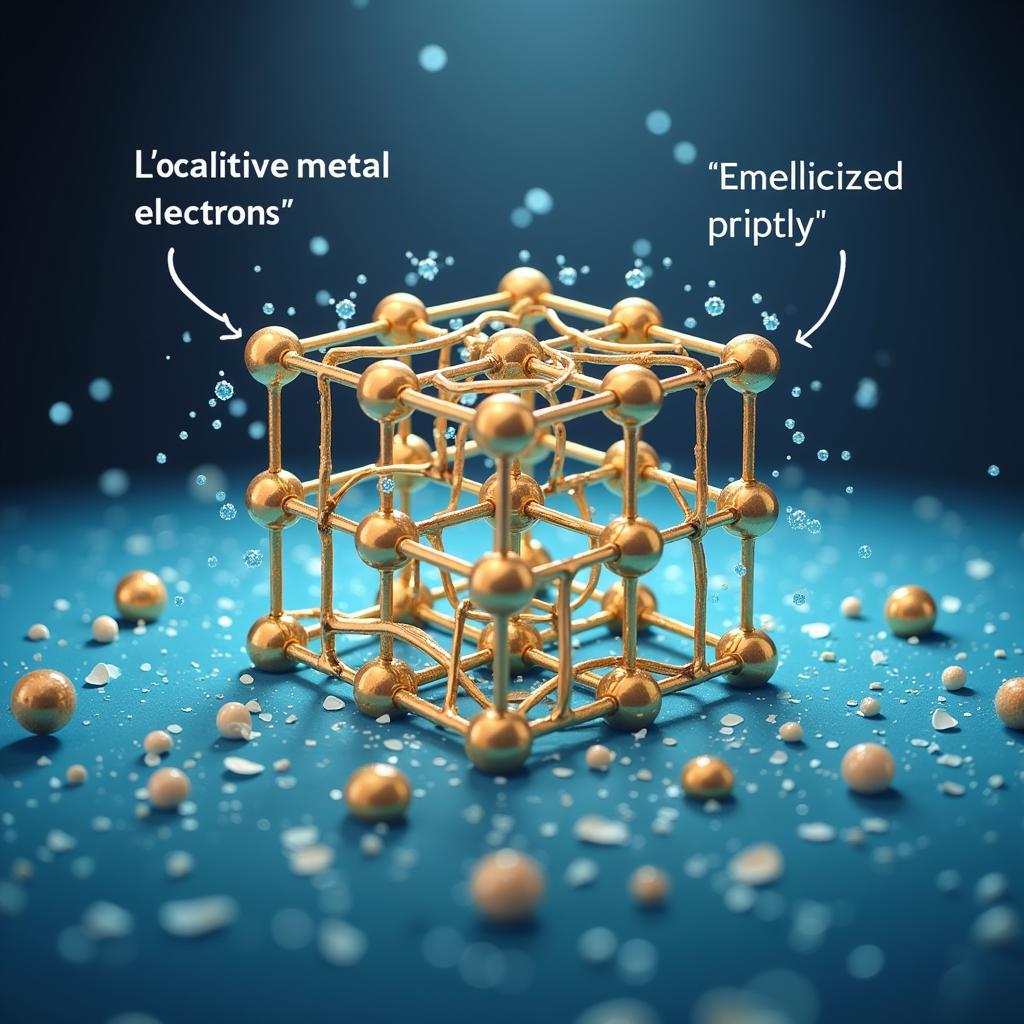 Hình ảnh minh họa liên kết kim loại
Hình ảnh minh họa liên kết kim loại
Liên Kết Hydro: Lực Hút Đặc Biệt
Liên kết hydro là một loại lực hút giữa phân tử, yếu hơn liên kết ion và cộng hóa trị, nhưng mạnh hơn các lực Van der Waals khác. Liên kết hydro hình thành khi một nguyên tử hydro liên kết với một nguyên tử có độ âm điện lớn (như O, N, F) tương tác với một nguyên tử có độ âm điện lớn khác trong một phân tử khác. Liên kết hydro đóng vai trò quan trọng trong nhiều hệ thống sinh học, ví dụ như cấu trúc của DNA và protein.
Kết luận
Các loại liên kết trong hóa học, bao gồm liên kết ion, liên kết cộng hóa trị, liên kết kim loại và liên kết hydro, đóng vai trò then chốt trong việc xác định tính chất của vật chất. Hiểu rõ về các loại liên kết này là bước đầu tiên để khám phá thế giới hóa học đầy bí ẩn và thú vị.
FAQ
- Liên kết nào mạnh nhất trong hóa học?
- Sự khác biệt giữa liên kết ion và cộng hóa trị là gì?
- Tại sao kim loại dẫn điện tốt?
- Liên kết hydro có vai trò gì trong nước?
- Làm thế nào để xác định loại liên kết trong một phân tử?
- Liên kết cộng hóa trị phân cực là gì?
- Ví dụ về các chất có liên kết kim loại là gì?
Gợi ý các bài viết khác:
- Cấu tạo nguyên tử
- Bảng tuần hoàn các nguyên tố hóa học
Khi cần hỗ trợ hãy liên hệ Số Điện Thoại: 0705065516, Email: thptquangtrung@gmail.com Hoặc đến địa chỉ: NB tổ 5/110 KV bình thường b, P, Bình Thủy, Cần Thơ, Việt Nam. Chúng tôi có đội ngũ chăm sóc khách hàng 24/7.


