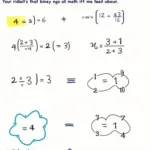Sự điện li, một khái niệm quan trọng trong Hóa Học 9 Bài 1 Trang 101, là nền tảng để hiểu về các phản ứng hóa học trong dung dịch. Bài viết này sẽ giúp bạn nắm vững kiến thức về sự điện li, từ định nghĩa đến ứng dụng, cùng với những ví dụ minh họa sinh động và dễ hiểu.
Sự điện li là quá trình phân li các chất thành ion khi tan trong nước. Hiểu đơn giản, khi một chất tan trong nước, nó có thể tách ra thành các hạt mang điện tích dương (cation) và điện tích âm (anion). Quá trình này chính là sự điện li. Hóa học 9 bài 1 trang 101 là bước khởi đầu cho hành trình khám phá thế giới dung dịch điện li. Nắm vững kiến thức này sẽ giúp các em học sinh dễ dàng tiếp cận các bài học phức tạp hơn về axit, bazơ, muối.
Định Nghĩa Sự Điện Li (Hóa Học 9 Bài 1 Trang 101)
Theo Hóa học 9 bài 1 trang 101, sự điện li được định nghĩa là quá trình phân li một chất thành các ion khi hòa tan trong nước. Các chất có khả năng điện li được gọi là chất điện li. Ngược lại, các chất không có khả năng điện li được gọi là chất không điện li.
Phân Loại Chất Điện Li
Chất điện li được chia thành hai loại chính: chất điện li mạnh và chất điện li yếu. Chất điện li mạnh phân li hoàn toàn thành ion khi tan trong nước, trong khi chất điện li yếu chỉ phân li một phần. Ví dụ về chất điện li mạnh bao gồm axit mạnh như HCl, HNO3, bazơ mạnh như NaOH, KOH và hầu hết các muối. Axit yếu như CH3COOH, bazơ yếu như NH3 và nước là những ví dụ điển hình cho chất điện li yếu. Bạn có thể tham khảo thêm bảng số hóa học để tra cứu thông tin về các nguyên tố và hợp chất hóa học.
Ý Nghĩa Của Sự Điện Li
Sự điện li đóng vai trò quan trọng trong nhiều lĩnh vực, từ hóa học đến sinh học. Nó là cơ sở để hiểu về tính dẫn điện của dung dịch, phản ứng trao đổi ion, và các quá trình hóa học xảy ra trong cơ thể sống.
Ứng Dụng Của Sự Điện Li Trong Đời Sống
Sự điện li có nhiều ứng dụng thực tiễn trong đời sống hàng ngày. Ví dụ, việc sử dụng muối để làm tan băng trên đường dựa trên nguyên tắc làm giảm điểm đóng băng của nước khi có chất điện li. Ngoài ra, sự điện li còn được ứng dụng trong các quá trình điện phân, mạ điện, và sản xuất pin. Có lẽ bạn sẽ quan tâm đến các mã ngành của trường đại học y hà nội nếu bạn muốn theo đuổi ngành y.
 Ứng dụng sự điện li
Ứng dụng sự điện li
Kết Luận
Hóa học 9 bài 1 trang 101 về sự điện li là một kiến thức nền tảng quan trọng trong chương trình Hóa học THCS. Nắm vững khái niệm này sẽ giúp học sinh hiểu sâu hơn về các phản ứng hóa học trong dung dịch và ứng dụng của chúng trong đời sống. Hãy cùng tiếp tục khám phá thế giới hóa học đầy thú vị! Bạn có thể tham khảo thêm bài học tiếng việt online để nâng cao kỹ năng ngôn ngữ của mình.
FAQs về Sự Điện Li
- Sự điện li là gì?
- Chất điện li mạnh và chất điện li yếu khác nhau như thế nào?
- Ví dụ về chất điện li mạnh và chất điện li yếu là gì?
- Ý nghĩa của sự điện li là gì?
- Ứng dụng của sự điện li trong đời sống là gì?
- Tại sao nước được coi là chất điện li yếu?
- Làm thế nào để xác định một chất có phải là chất điện li hay không?
Bạn cũng có thể tìm hiểu thêm về các trang web học tiếng hàn miễn phí nếu bạn quan tâm đến việc học ngoại ngữ. Hoặc nếu bạn muốn thư giãn sau những giờ học căng thẳng, hãy tránh xa những nội dung không lành mạnh như clip cô giáo khoả thân trong giờ học online.
Khi cần hỗ trợ hãy liên hệ Số Điện Thoại: 0705065516, Email: thptquangtrung@gmail.com Hoặc đến địa chỉ: NB tổ 5/110 KV bình thường b, P, Bình Thủy, Cần Thơ, Việt Nam. Chúng tôi có đội ngũ chăm sóc khách hàng 24/7.