Công Thức Tính Thể Tích Hóa Học là một phần quan trọng trong chương trình Hóa học THPT và THCS, giúp học sinh giải quyết các bài toán liên quan đến lượng chất khí. Nắm vững kiến thức này không chỉ giúp các em đạt điểm cao trong các kỳ thi mà còn tạo nền tảng vững chắc cho việc học tập ở bậc cao hơn.
Các yếu tố ảnh hưởng đến thể tích chất khí
Thể tích của một chất khí không phải là một hằng số mà phụ thuộc vào các yếu tố như nhiệt độ, áp suất và số mol.
- Nhiệt độ: Khi nhiệt độ tăng, các phân tử khí chuyển động nhanh hơn và va chạm mạnh hơn vào thành bình, dẫn đến thể tích khí tăng lên. Ngược lại, khi nhiệt độ giảm, thể tích khí cũng giảm theo.
- Áp suất: Áp suất càng cao, các phân tử khí bị nén chặt hơn, làm giảm thể tích khí. Ngược lại, áp suất càng thấp, thể tích khí càng tăng.
- Số mol: Số mol khí tỉ lệ thuận với thể tích khí. Điều này có nghĩa là khi số mol khí tăng lên, thể tích khí cũng tăng theo và ngược lại.
Công thức tính thể tích chất khí lý tưởng
Để tính thể tích của một chất khí lý tưởng, ta sử dụng công thức sau:
PV = nRT
Trong đó:
- P: Áp suất của khí (thường được đo bằng atm hoặc Pa)
- V: Thể tích của khí (thường được đo bằng lít hoặc m3)
- n: Số mol của khí (đơn vị là mol)
- R: Hằng số khí lý tưởng (R = 0,0821 L.atm/mol.K hoặc R = 8,314 J/mol.K)
- T: Nhiệt độ tuyệt đối của khí (đơn vị là Kelvin, K = °C + 273)
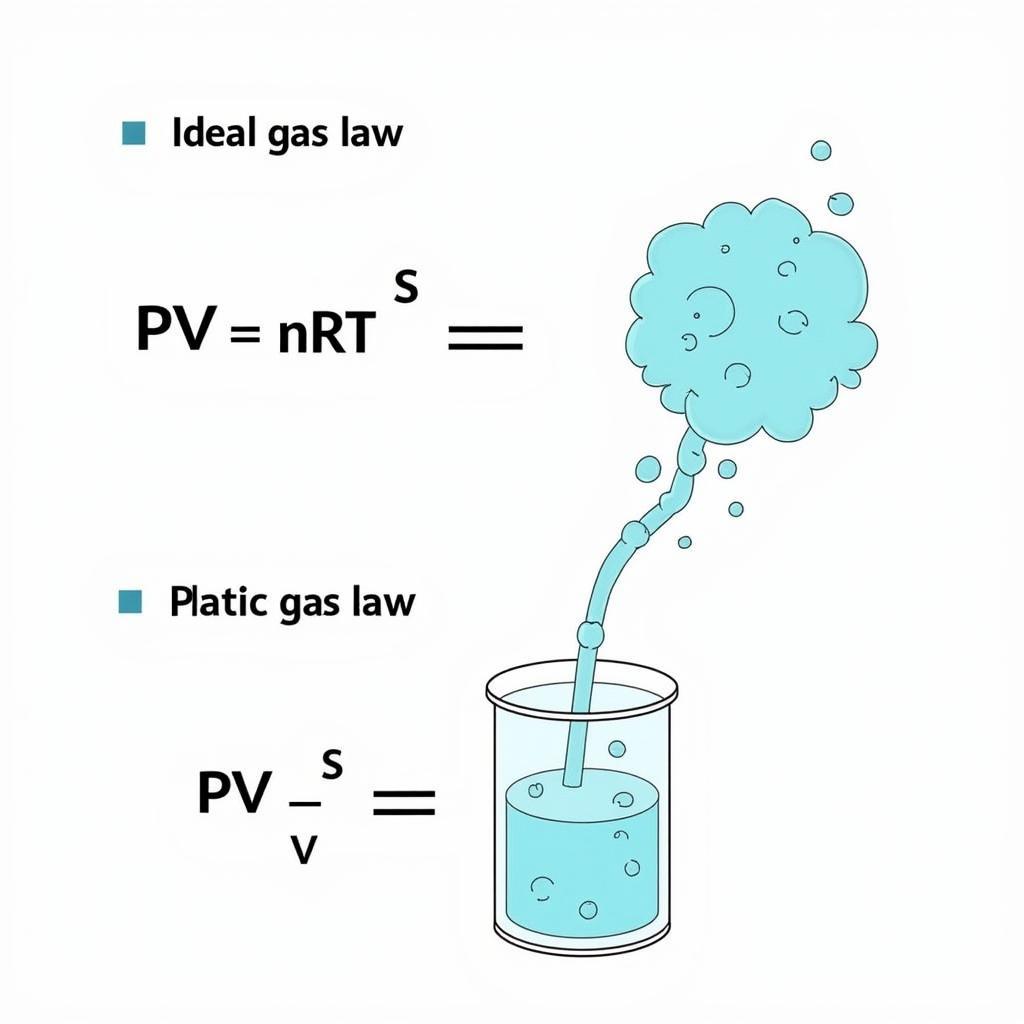 Công thức tính thể tích khí lý tưởng
Công thức tính thể tích khí lý tưởng
Áp dụng công thức tính thể tích trong bài tập
Công thức tính thể tích chất khí có thể được sử dụng để giải quyết nhiều dạng bài tập khác nhau, ví dụ như:
-
Tính thể tích của một lượng khí cho trước:
Ví dụ: Tính thể tích của 2 mol khí oxi (O2) ở điều kiện tiêu chuẩn (áp suất 1 atm, nhiệt độ 273K). -
Tính khối lượng hoặc số mol của khí dựa vào thể tích:
Ví dụ: Một bình chứa 5 lít khí nitơ (N2) ở áp suất 2 atm và nhiệt độ 25°C. Tính số mol khí nitơ có trong bình. -
So sánh thể tích của các khí khác nhau:
Ví dụ: So sánh thể tích của 1 mol khí hidro (H2) và 1 mol khí cacbon dioxit (CO2) ở cùng điều kiện nhiệt độ và áp suất.
Mẹo ghi nhớ công thức và áp dụng hiệu quả
Để ghi nhớ công thức tính thể tích chất khí, học sinh có thể sử dụng các mẹo sau:
- Viết tắt: Ghi nhớ cụm từ “Phải Vui như Rùa Tắm” để nhớ thứ tự các đại lượng trong công thức.
- Thực hành: Làm nhiều bài tập áp dụng công thức để quen thuộc với cách tính toán và biến đổi công thức.
- Liên hệ thực tế: Tìm hiểu ứng dụng của công thức tính thể tích chất khí trong đời sống hàng ngày để tăng hứng thú học tập.
 Ứng dụng công thức tính thể tích trong đời sống
Ứng dụng công thức tính thể tích trong đời sống
Kết luận
Công thức tính thể tích hóa học là một công cụ quan trọng giúp học sinh hiểu rõ hơn về tính chất và ứng dụng của chất khí. Việc nắm vững công thức này không chỉ giúp các em đạt kết quả tốt trong học tập mà còn trang bị kiến thức hữu ích cho tương lai.
Câu hỏi thường gặp
1. Công thức tính thể tích khí lý tưởng có áp dụng được cho khí thực hay không?
2. Làm thế nào để chuyển đổi đơn vị của các đại lượng trong công thức tính thể tích?
3. Ngoài công thức PV = nRT, còn có công thức nào khác để tính thể tích chất khí?
4. Điều gì xảy ra với thể tích khí khi cả nhiệt độ và áp suất đều thay đổi?
5. Làm cách nào để xác định được hằng số khí lý tưởng (R) phù hợp với bài toán?
Bạn cần hỗ trợ?
Liên hệ ngay với chúng tôi!
Số Điện Thoại: 0705065516
Email: thptquangtrung@gmail.com
Hoặc đến địa chỉ: NB tổ 5/110 KV bình thường b, P, Bình Thủy, Cần Thơ, Việt Nam.
Chúng tôi có đội ngũ chăm sóc khách hàng 24/7.

